作者:陈馨宁 黄 斐 姜惠琴 沈敏娜,复旦大学附属中山医院检验科
使用血液样本进行血浆表皮生长因子受体(epidermal growth factor receptor,EGFR)基因检测已经成为非
本研究报道1例EGFR:c.2572_2573delinsAG阳性NSCLC患者,采用改进的突变扩增阻碍系统(super amplification refractory mutation s y s t e m,S u p e r-A R M S)检测血浆循环游离DNA(circulating tumor DNA,ctDNA),未检出该突变;采用抑制探针置换扩增(blocker displacement amplification,BDA)法检出该突变位点。
1 病例资料
1.1 简要病史
患者,男,87岁,发现肺部恶性肿瘤1年,因无症状未行治疗,2020年11月31日主诉“近期
1.2 血浆EGFR基因检测结果
采集患者静脉血10 mL,乙二胺四乙酸抗凝。采用两步离心法,4 ℃ 1 600×g离心10 min, 分离血浆,4 ℃ 16 000×g再次离心10 min,吸取上清4 mL,采用核酸提取试剂(厦门艾德生物
医药公司)抽提ctDNA,分别采用Super-ARMS和BDA法检测。Super-ARMS试剂盒购自厦门艾德生物医药科技股份有限公司,BDA法试剂盒购自上海阅尔基因技术有限公司,检测仪器均为7500实时荧光定量PCR仪(美国ABI公司)。
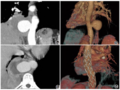
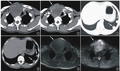
血浆EGFR基因检测结果见图1。SuperA R M S未检出E G F R突变,B D A法检出E G F R基因2 1号外显子L 8 5 8 R突变,位点为c.2572_2573delinsAG,该位点不在Super-ARMS检测范围内。
随后使用S a n g e r测序[委托铂尚生物技术(上海)有限公司进行,上游引物为5'-GCTCCCAGTACCTGCTCAAC-3',下游引物为5'-TGATAGGCACTTTGCCTCCT-3']和二代测序[试剂盒购自南京诺唯赞生物科技股份有限公司,检测仪器为 MiSeq测序仪(美国Illumina公司)]进行复核,结果同BDA法。同时,为避免存在克隆造血影响,对患者基因组DNA中该位点进行检测,结果为阴性。


2 讨论
S u p e r-A R M S技术基于A R M S,是肿瘤相关分子检测的主要技术之一,检测下限为0.2%~0.8%[ 2-3] 。基于该技术的EGFR试剂盒是中国国家药品监督管理局首次按照伴随诊断试剂标准审评并批准上市的产品。BDA法是基于聚合酶链反应(polymerase chain reaction,PCR)的突变富集技术,在野生型DNA背景下选择性地扩增基因突变,利用引物和抑制探针之间的竞争关系提高PCR的效率和低丰度突变检出率,检测下限为0.01%~0.10%[4] 。
基于特定突变位点探针和引物的PCR方法只能检测有限数量和已知的特异性突变,而测序可以揭示所有分析序列中的异常,包括罕见和未知突变,见图2。由于Sanger测序灵敏度相对较低(10%),因此采用BDA技术补充检测EGFR第18~21号外显子全部突变,具有在常规EGFR基因突变基础上获得更多临床和科研价 值[5] 的优势。
EGFR基因与肿瘤的发展、增殖、侵袭和转移密切相关,根据EGFR基因突变结果指导NSCLC患者进行表皮生长因子酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitor,EGFR-TKI)治疗已经成为标准临床实践方法[1] 。然而,临床诊疗过程中肺癌组织受检率并不高,导致基于驱动基因突变靶点的个体化治疗策略难以实施。多项回顾性和前瞻性研究结果均表明,当肿瘤组织难以获取时,血液ctDNA检测是合适的突变分析替代选 择[1] 。和传统活检相比,液体活检具有无创、可实时检测、克服肿瘤异质性等特点。因此,血液EGFR基因突变检测的临床价值逐渐突显[6] 。
E G F R基因2 1号外显子L 8 5 8 R突变占所有突变的3 2%,常见的突变形式为c.2 5 7 3 T>G,也有c.2 5 7 3_2 5 7 4 d e l i n s G T和c.2573_2574delinsGA突变相关报道[7] 。本例患者检出的c.2572_2573delinsAG位点也属于L858R突变,但鲜有报道。L858R突变患者为EGFR敏感突变,此类患者酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)的疗效优于化疗。因此,L858R突变的检出无疑增加了患者的治疗选择和机会。除了常见突变外,其余突变也可以帮助临床为患者做出更好的临床决策。非经典突变主要包括G719X(18号外显子)、S768I(20号外显子)、L861Q(21号外显子)突变[8] ,目前基本已包括在基于PCR方法的商品化诊断试剂盒的检测范围内。但另有罕见突变,如18del、E709X和19ins,其发生频率<0.5%,在非测序方法中被忽视。E709X对一代TKI的反应介于经典EGFR突变和EGFR野生型之间。18del、E709X和19ins均对二代TKI敏感,但相关临床数据较少,仅有相关病例报道患者治疗后获部分缓解[9] 。此外,常见突变类型中特定的突变位点可能对TKI表现出独特甚至相反的选择性,如EGFR基因第19外显子缺失中p.L747-A750>P与其他缺失类型相比,患者接受厄洛替尼治疗获得的临床结局更差[10-11] ;除p.A763_Y764insFQEA和p.A763_Y764insLQEA外,携带EGFR基因第20外显子插入的患者对EGFR-TKI治疗普遍不敏感[12-13] 。因此,更深入、更全面地开展肿瘤分子检测可以帮助了解罕见突变如何影响EGFR蛋白结构和TKI结合效力[14-15] ,为NSCLC患者提供更有价值的治疗见解,以实现精准的个体化治疗。
参考文献略。
来源:陈馨宁,黄斐,姜惠琴等.非小细胞肺癌患者血浆EGFR基因c.2572_2573delinsAG位点突变1例报道[J].检验医学,2023,38(10):1003-1005.
- 上一篇:右上肺叶切除术后支气管残端瘘一例
- 下一篇:1例椎管内恶性神经鞘瘤诊治报告并文献复习