作者:李星寰,云南省阜外心血管病医院麻醉科;贾爰,中国医学科学院阜外医院麻醉中心
1.病例资料
患儿,男,39天,3.7kg,ASAⅣ级,因“孕18周发现胎儿心脏结构异常”入院。足月顺产,出生体重2.8kg,无窒息抢救史;入院时精神一般,母乳喂养,二便正常;吸空气血氧饱和度(oxygen saturation,SpO2)85%~89%,吸氧后SpO2 92%~95%,四肢
入院后持续泵注
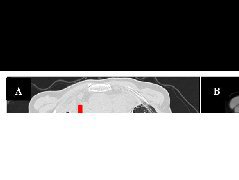
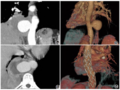
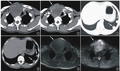
术前诊断:内脏异位综合征,肺动脉闭锁,右室单出口(大动脉异位),完全性心内膜垫缺损(A型),单组房室瓣关闭不全,动脉导管未闭,体肺动脉侧支形成,室间隔缺损,房间隔缺损,右位主动脉弓,无顶冠状静脉窦,永存左上腔静脉,左上腔静脉、下腔静脉连接左侧心房,右上腔静脉连接右侧心房,右侧心耳异构,无脾综合征,

患儿入室后,吸空气SpO2 85%,心率(heart rate,HR)151次/分,前列地尔2ng/(kg/min),艾司洛尔12mg/h。常规静脉诱导置入3.5#带囊气管导管,股动脉血压55/22mmHg;右颈内静脉置管;持续监测组织氧饱和度,脑组织氧饱和度52%、肾区组织氧饱和度67%;ABG(FiO2 30%):pH7.378,PaO256.8,SaO2 87.7%,PaCO2 40.7,lac0.6,BE-1.2,Hb120,K+4.60,Glu2.36,对症补充
颈内静脉穿刺过程中患儿发作室上速,心室率210次/分,ABP降至24/14mmHg,给予甲氧明1mg静脉注射,恢复窦性心律同时血压恢复正常;手术期间,在充分镇静镇痛下(
术中行中心分流术,以一5mm人工血管连接主肺动脉与升主动脉,随后结扎PDA。游离血管时循环稍有波动,泵注多巴胺和多巴酚丁胺合剂3μg/(kg·min)并停用艾司洛尔;主动脉侧壁钳钳夹时,间断出现血压下降,
其后发现人工血管过长,为避免打折等情况需拆除并更换,将FiO2上调为60%后临时阻断人工血管,患儿各项指标均无明显变化,遂于保持PDA结扎状态下重新缝合,过程顺利。患儿鱼精蛋白中和(术中
情况稳定后ABG(FiO230%):pH7.169,PaO280.6,SaO291.2%,PaCO241.7,lac8.8,BE-13.4,Hb93,K+6.11,Glu14.78,提示代谢性酸中毒、
入PICU后继续机械通气,呼吸机SIMV模式(PIP/PEEP14/4cmH2O,呼吸频率35次/分,FiO240%),SpO292%,HR180次/分,ABP62/24mmHg,CVP5mmHg;ABG(FiO240%):pH7.356,PaO259.6,SaO287.10%,PaCO241.8,lac4.3,BE-1.2,Hb122,K+4.76,Glu11.72。术后当日夜,随镇静镇痛程度下降患儿血压有所升高,逐渐减量多巴合剂至2μg/(kg·min)、肾上腺素至0.05μg/(kg·min);于深夜出现血压下降同时尿量减少,逐步提高多巴合剂至6μg/(kg·min)、肾上腺素至0.1μg/(kg·min),加用
术后第一日凌晨突然血压骤降,ABP30/12mmHg,CVP5mmHg,HR158次/分,窦律,肾上腺素50μg静脉注射无改善,HR降至85次/分,立即胸外按压同时床旁紧急开胸建立体外循环辅助,其后自主心率恢复至160次/分,但间断发作室速室颤,行ECMO辅助。后因胸液引流量多床旁开胸止血3次,术后第二日夜ECMO流量逐渐降低,皮肤出现片状淤斑,凝血功能检测提示
2.讨论
本例患儿主要诊断为内脏异位综合征,右心房异构/无脾型。该综合征是由于胚胎时期左右体轴不对称结构发育异常引起的心脏和心外脏器位置异常,发病率约万分之一,在
右心房异构最常见的合并畸形依次为肺动脉瓣或瓣下狭窄(91%)、房室间隔缺损(81%)、双侧上腔静脉(71%)、单心房(67%)、功能性单心室(57%)和右位主动脉弓(50%);左心房异构最常见合并畸形依次为下腔静脉肝段中断(72%)、肺动脉瓣或瓣下狭窄(72%)、右室双出口(55%)、右位主动脉弓(45%)和冠状动脉畸形(45%);由于心房异构的存在,患儿可出现心律失常如室上性心动过速、窦房结功能障碍等。
临床以右心房异构多见,外科治疗基本以单心室功能矫治为目标行分期Fontan手术,根据患儿肺血情况一期行体肺分流术或肺动脉环缩术。本例患儿合并多重心内心外畸形,与手术指征相关的诊断为单心室合并肺动脉闭锁(single ventricle morphology with pulmonary atresia,SV-PA),尽管术前无明显发绀,但前列地尔无法停药,最终行体肺分流术。
体肺分流术是发绀型复杂先天性心脏病重要的姑息性治疗术式,在改善患儿氧合的同时促进肺动脉发育,为二期手术创造条件;常用术式为改良B-T分流术(modified Blalock-Taussig shunt,MBTS)与中心分流术(central shunt,CS),本例患儿接受了CS。Dorobantu等回顾了2000—2012年英国25个中心的数据,发现SPSs术后30d平均死亡率为9.8%,SV-PA患儿是手术死亡率增高的危险因素,接受CS与术后再次手术干预风险增高相关,未接受再次手术的SV-PA患儿术后30d死亡率为11.4%,若接受再次手术则死亡率约为21%。
SPSs围麻醉期管理重点为肺循环血量与体循环血量的再分配以及术后出血与血栓风险的权衡。相对于MBTS,CS一般不容易发生人工血管血栓形成与栓塞,但容易出现过度分流导致肺血过多而体循环灌注不足。Ismail等定义过度分流为术后6h内,在不同情境下任意6个时间点平均SpO2>85%(FiO221%),且DBP≤SBP×35%(脉压过大);相应的优化肺循环血量与体循环血量平衡的具体措施包括:
①调整通气参数降低肺循环血量,在患儿可耐受情况下逐步降低FiO2至21%,适度通气不足,将pH维持在7.35~7.40;②保证镇静镇痛的基础上调整血管活性药物降低体循环阻力增加体循环血量,逐步降低血管收缩剂用量,必要时使用血管舒张剂,但保持DBP>25mmHg以维持心脏灌注;③必要时再次手术减小人工血管内径。
本例患儿术前吸空气SpO2>85%,评估肺循环血量与体循环血量变化主要依靠血压变化。开放人工血管并结扎PDA后,患儿ABP波动于61~50/28~18mmHg,脉压相比基础值无明显改变,PetCO2亦无明显变化,未提示肺循环血量明显增多。但考虑到患儿术前PDA内径5mm,由降主动脉连接左肺动脉且走形迂曲,人工血管内径也为5mm,由升主动脉连接主肺动脉且走形短直,理论上分流量将大于术前,因此重新开放人工血管后呼吸机通气FiO230%,适度通气不足,防止肺血管阻力的进一步降低;同时,由于患儿基础DBP较低,在充分镇静镇痛同时继续使用多巴合剂3μg/(kg·min)维持一定的冠状动脉灌注压。
手术主要步骤结束后的观察期间内,患儿循环稳定,血气提示内环境稳定,随后考虑给予鱼精蛋白中和,10min后出现心率血压下降。在鱼精蛋白缓慢推注过程中患儿无血压变化、气道压增加、右心室胀满等表现,排除I型、Ⅲ型鱼精反应。对于鱼精蛋白相关的过敏反应,由于血管通透性改变和体液的再分布导致血压骤降,可观察到心腔突然变空和心率反应性增加,本例患儿无上述表现,但在使用大剂量肾上腺素后循环恢复,因此心率血压下降可能与过敏性
此外,由于无尿,在鱼精蛋白中和前患儿血钾为5.77mmol/L,血浆钾浓度过高导致将心室肌3期复极时内向整合钾电流增大、心肌跨膜电位减小、动作电位降低,出现心率减慢,窦房结、房室结传导阻滞,由于婴幼儿血压依赖心率,心率减慢时血压随之下降。本例患儿术前积极使用利尿剂,术中容易出现少尿并引发高钾血症,对尿量的密切监测更为重要,这也是本例麻醉处理忽视之处。
术后患儿于PICU内镇静镇痛药物逐渐减量,夜间出现血压下降及尿量减少,逐渐增大强心药物剂量并使用血管收缩剂;随后患儿状况并未好转并出现血压骤降且肾上腺素推注无效,导致床旁紧急开胸建立体外循环辅助。镇静镇痛程度不足与大剂量血管收缩剂可能进一步增加体循环阻力减少体循环血量,导致肺循环血量与体循环血量进一步失衡。
同时当进一步回顾病例时,我们发现术中使用肾上腺素后患儿最高ABP99/26mmHg,SBP显著增高而DBP无明显改变,这提示对于本例患儿使用强心药或血管收缩药以提高DBP增加冠状动脉灌注的效果十分有限。
心脏灌注不足,同时肺血相对过多,心室容量过负荷,心肌缺血与心室前负荷过重逐渐形成恶性循环,患儿间断发作的室上速可能进一步导致情况恶化,最终出现循环难以维持。因此,当患儿于PICU出现血压下降时,PICU医师应立即联系外科医师、麻醉医师进行多学科会诊,综合评估患儿情况,评估是否需要进行容量治疗或再次手术减小人工血管内径,单纯增大强心药物剂量并使用血管收缩药可能并无益处。本例患儿紧急床旁开胸后,由于连续的手术打击与长时间的体外循环导致凝血系统功能障碍,引发DIC。
总结本例患儿经验教训,对于内脏异位综合征,右心房异构型患儿接受体肺分流术,由于患儿术前普遍存在年龄小、体重低、一般状态差、本身疾病重等情况,同时该类手术术后死亡率较高,手术风险极大,围手术期需要外科医师、麻醉科医师、重症监护室医师通力合作与密切沟通。术后关注重点为优化肺循环血量与体循环血量平衡,维持DBP>25mmHg保证心脏灌注,并积极处理心律失常;同时权衡术后出血与血栓风险,加强凝血功能监测。
来源:李星寰,贾爰.内脏异位综合征患儿围手术期灾难性血流动力学变化1例[J].中国分子心脏病学杂志,2022,22(2):4629-4632.
- 上一篇:纳武利尤单抗成功治疗转移性卡波西肉瘤
- 下一篇:肺诺卡氏菌病差点误诊?注意鉴别诊断